Para que un enlace sea iónico debe existir una apreciable diferencia de electronegatividad, de modo que uno de los átomos atraiga con más fuerza un electrón y ambos quedan cargados. De este modo, este modelo de enlace supone que ambos iones se comportan como cargas puntuales e interaccionan de acuerdo a la ley de Coulomb.
Este tipo de enlaces es típico de moléculas formadas por un elemento del grupo 7A (halógenos) y un elemento del grupo 1A (alcalinos). Los halógenos son muy electronegativos porque les falta sólo un electrón para cumplir con la regla del octeto y alcanzar la configuración electrónica de un gas noble. Esto hace que atraigan un electrón del elemento alcalino. Los alcalinos tienen un electrón en la última capa, y lo liberan fácilmente para cumplir con la regla del octeto. Ambos elementos quedan cargados: el halógeno negativo y el alcalino, positivo:
LOPEZ MEJIA ALEJANDRA PATRICIA
ESTRUCTURA DE LEWIS
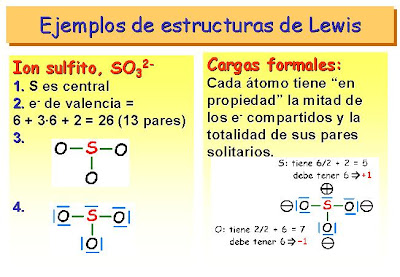
Las estructuras de Lewis son representaciones adecuadas y sencillas de iones y compuestos, que facilitan el recuento exacto de electrones y constituyen una base importante para predecir estabilidades relativas.
Fuente:UAM
Martínez Cureño Rosario








No hay comentarios:
Publicar un comentario